Le traitement du carcinome hépatocellulaire
Comment se prend la décision thérapeutique ?
La décision thérapeutique se prend lors d’une réunion de concertation pluridisciplinaire (RCP) qui réunit des hépatologues, des radiologues, des chirurgiens, des cancérologues et des anatomo-pathologistes, tous spécialisés dans le cancer du foie.
Lors de cette réunion, le médecin référent présente le dossier de son patient, le radiologue apporte une relecture des différents examens réalisés et les différentes possibilités de traitement sont discutées.
Cette RCP propose une prise en charge du malade qui peut comporter la réalisation de nouveaux examens si ceux présents dans le dossier ne permettent pas de prendre une décision.
Ensuite, la proposition de traitement sera présentée au patient par son médecin qui pourra alors répondre à ses questions.
Lors du suivi du cancer, le dossier sera discuté à chaque fois que cela sera nécessaire pour évaluer la nécessité d’une nouvelle prise en charge thérapeutique.
1. La chirurgie
Quelle est la place de la chirurgie dans le traitement des cancers du foie ?
La chirurgie d’exérèse consiste à retirer le cancer qui se présente souvent comme une ou plusieurs « sphères » plus ou moins volumineuses, en préservant suffisamment de volume de foie non tumoral pour assurer les fonctions vitales. Cette opération s’appelle une hépatectomie. Elle est possible si le volume global du foie est important mais aussi et surtout si le foie est sain et a donc une capacité de régénération. La régénération du foie est un phénomène où le foie restant après exérèse augmente de volume pour redonner au patient opéré une fonction hépatique normale.
Pour être efficace sur le cancer du foie, il faut que cette opération emporte le cancer avec une marge de foie sain autour du cancer, on parle de « marge de résection ». Cette marge de résection doit être au mieux supérieure ou égale à 1 cm. La chirurgie doit toujours emporter la totalité des lésions visibles sur les examens d’imagerie réalisés préalablement. Dans le cas des cancers primitifs du foie, la chirurgie n’est donc effectuée que si la maladie est localisée au foie. La chirurgie est souvent réalisée pour un nodule unique dans le foie, rarement en présence de 2 nodules et exceptionnellement en présence de 3 nodules ou plus. La taille du nodule a moins d’importance que le nombre de nodules.
Dans certains cas, la chirurgie d’exérèse est impossible car le foie restant est trop petit et/ou déjà malade donc peu fonctionnel et sans capacité de régénération. Dans ce cas, la transplantation hépatique est une solution qui consiste à retirer la totalité du foie malade et à le remplacer par un foie sain prélevé chez un donneur le plus souvent en mort encéphalique. Cette solution n’est cependant envisageable que si la maladie répond à des critères très stricts qui prennent en compte le nombre de nodules, la taille du plus gros nodule et le taux d’alpha-foetoprotéine ou AFP, principal marqueur des tumeurs du foie.
Quels sont les différents types d’interventions chirurgicales ?
Une hépatectomie est une exérèse d’une partie du foie. Une hépatectomie peut être majeure ou mineure en fonction du volume de foie retiré. une hépatectomie majeure emporte souvent la partie droite ou la partie gauche du foie et n’est possible que si le volume de foie restant est au moins égal à 0.5% du poids corporel. Si le volume du foie est insuffisant, il est nécessaire de réaliser une « embolisation portale » préalable de la partie de foie qui devra être retiré afin de faire grossir le futur foie restant.
L’embolisation portale consiste à boucher la veine porte qui alimente une partie du foie. C’est une procédure qui est faite à l’occasion d’une courte anesthésie générale. Dans l’immense majorité des cas, il s’agit d’une embolisation de la branche porte du foie droit. Cette embolisation est faite par une ponction à travers la peau sous guidage échographique de la branche porte qui doit être bouchée. Cette embolisation va entrainer en 15 jours à 1 mois, une diminution de volume du foie occlus et une augmentation du foie opposé, souvent le foie gauche.
Les hépatectomies peuvent être réalisées par voie ouverte (laparotomie), ou à ventre fermé (cœlioscopie ou laparoscopie).
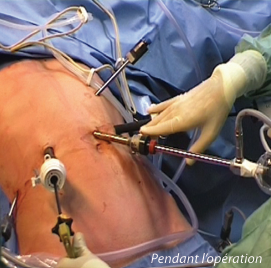
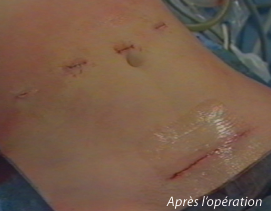
La cœlioscopie (ou laparoscopie) consiste à réaliser des opérations à travers des cylindres (trocarts), de 8 à 10 cm de long et 5 à 10 mm de diamètre, qui sont passés à travers la paroi abdominale pour pouvoir y introduire des instruments chirurgicaux (ciseaux, pinces, bistouri électrique). Les instruments chirurgicaux peuvent alors atteindre le foie sous la surveillance d’une caméra (endoscope), elle aussi introduite à travers un trocart. Afin de disposer d’espace de travail dans la cavité abdominale, cette opération débute par l’insufflation de gaz carbonique afin de distendre l’abdomen lors de la mise en place du premier trocart, souvent à proximité de l’ombilic. La chirurgie du foie est faite sous cœlioscopie dans 12% à 20% des cas, souvent pour des tumeurs superficielles du foie faciles d’accès même si des hépatectomies plus profondes peuvent être réalisées. Outre l’intérêt esthétique indéniable, la cœlioscopie diminue la durée d’hospitalisation et peut simplifier des interventions chirurgicales ultérieures, en particulier la transplantation.
La cœlioscopie reste cependant uniquement une voie d’abord et n’est réalisée que si les obligations du chirurgien vis-à-vis du traitement du cancer (détection de toutes les tumeurs et marge de sécurité) sont respectées. Pour ces raisons, certaines localisations tumorales au contact de structures vasculaires importantes et/ou difficiles à identifier au cours de la chirurgie seront uniquement traitables par voie ouverte. La voie ouverte, à la différence de la cœlioscopie, permet de palper le foie en cas de doute quant à la présence de tumeur(s) et surtout de libérer le foie de ces attaches anatomiques afin de le positionner dans une orientation qui permettra d’enlever des tumeurs dans des localisations profondes et postérieures.
Dans le cas de la transplantation du foie, on commence par une hépatectomie totale, c’est-à-dire par une exérèse de la totalité du foie malade. Cette opération se fait toujours par voie ouverte. Après cette ablation du foie, on met en place le greffon hépatique. Le greffon hépatique a été prélevé chez le donneur en sectionnant la voie biliaire principale ainsi que les vaisseaux qui rentrent (veine porte et artère hépatique) et qui sortent (veines hépatiques) du foie. Ce sont les mêmes conduits que l’on a sectionnés lors de l’hépatectomie totale chez le patient qui va recevoir la greffe. Les veines hépatiques, la veine porte, l’artère hépatique puis la voie biliaire principale du foie greffé seront donc reconnectées avec les conduits correspondants chez le receveur.
Comment se déroule l’intervention ?
Dans l’immense majorité des cas, le patient est hospitalisé la veille de
l’opération pour la réalisation d’un bilan biologique préopératoire immédiat et une dernière vérification par l’anesthésiste. Le jour de l’opération, le patient est emmené au bloc opératoire pour être endormi par les anesthésistes sur la table d’opération. Juste après cette « induction anesthésique » qui entraine une inhibition des mouvements respiratoires, il est mis en place une sonde dans les voies respiratoires (canule d’intubation) qui permet la réalisation d’une respiration artificielle ou ventilation mécanique. une sonde gastrique est ensuite souvent mise en place à travers une narine : cette sonde permet d’aspirer le contenu de l’estomac. une sonde urinaire, également placée le jour de l’opération, permet de suivre la quantité d’urine produite par le patient pendant la chirurgie (diurèse).
Finalement, la chirurgie commence en général 30 à 45 minutes après l’arrivée du malade en salle d’opération après une installation qui se termine en mettant en place des « champs » opératoires stériles qui vont encadrer la zone où sera faite la chirurgie.
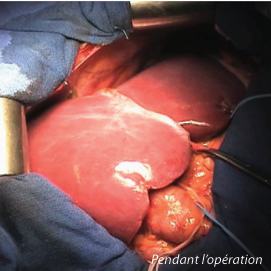
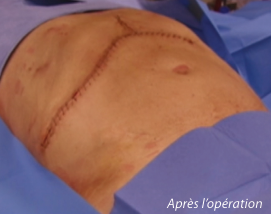
Si la chirurgie est effectuée par laparotomie, il est donc réalisé une incision de la paroi abdominale qui est oblique ou horizontale 3 à 8 cm sous le rebord costal inférieur droit. Cette incision est associée ou non à une incision verticale au-dessous de l’ombilic qui se prolonge vers le sternum. L’incision mesure au total entre 15 cm et 20 cm de long chez l’adulte. Afin d’ouvrir plus largement la zone opératoire, des écarteurs sont mis en place pour rétracter les côtes vers le haut à droite et à gauche.
Si la chirurgie est faite par cœlioscopie (ou laparoscopie), le chirurgien va commencer par mettre en place des trocarts à travers la paroi abdominale (voir Q23) afin d’y introduire ensuite une caméra et des instruments chirurgicaux.
Dans tous les cas, l’intervention commence par une exploration de la cavité abdominale et du foie afin de rechercher une maladie qui n’aurait pas été identifiée par les examens radiologiques préopératoires. L’exploration est visuelle mais aussi palpatoire, ce qui est plus difficile par coelioscopie. La qualité du foie est évaluée visuellement par l’analyse de sa surface et de sa consistance. L’intérieur du foie est analysé par une exploration échographique où la sonde d’échographie est posée directement à la surface du foie. Là encore, l’objectif est de rechercher dans le foie des lésions qui n’auraient pas été identifiées lors des examens préopératoires. Cette échographie est véritablement « l’œil du chirurgien » dans le foie : elle permet de repérer les structures anatomiques qui vont guider la chirurgie. C’est aussi grace à l’échographie que l’on détermine la zone de section du foie afin de préserver une marge de foie sain au pourtour de la zone tumorale qui sera réséquée. A ce stade, il est possible d’annuler l’opération et/ou de changer de stratégie de traitement si l’inspection visuelle, la palpation ou l’échographie du foie découvrent des lésions inattendues vis-à-vis du bilan d’imagerie préopératoire.
L’hépatectomie est ensuite débutée. L’hépatectomie consiste à sectionner le tissu hépatique ou « parenchyme hépatique » avec des instruments spécifiques. L’organisation du foie ressemble à celle d’un arbre où le chirurgien aborde le foie comme s’il était situé à la surface de l’arbre où sont situées les feuilles.
Souvent, le tissu hépatique lui-même, l’équivalent des feuilles, est « vaporisé » avec un bistouri à ultra-sons et les structures vasculaires, l’équivalent des branches, sont ligaturées et sectionnées. Outre les structures vasculaires, les branches pédiculaires contiennent des petites branches biliaires qui, elles, transportent la bile des feuilles vers le tronc. L’art du chirurgien hépatique consiste à sectionner uniquement les branches pédiculaires et veineuses qui nourrissent et drainent la zone de foie qui doit être retirée sans abimer les branches adjacentes.
Pour rendre plus simple la progression au sein du parenchyme hépatique, il est parfois nécessaire de clamper le pédicule hépatique qui contient le tronc principal de la veine porte et de l’artère hépatique. Sous clampage, le foie ne reçoit plus de sang, il est donc plus simple de sectionner le foie et de repérer les structures vasculaires à sectionner mais ce clampage doit être intermittent s’il dépasse 15 minutes.
Au terme de l’hépatectomie, le foie est repositionné et l’on vérifie par l’analyse de sa surface et de la zone de section qu’il n’existe pas de zones de foie mal vascularisées et/ou de fuites de sang ou de bile.
Si la vésicule biliaire est située dans la zone de l’hépatectomie, elle sera retirée. Dans certains cas, il est parfois nécessaire d’emporter la voie biliaire principale qui est le conduit permettant à la bile produite par le foie de rejoindre le tube digestif . Dans cette situation, il est donc nécessaire de reconstituer une communication entre les canaux biliaires qui s’abouchaient dans la voie biliaire principale et le tube digestif. Pour ce faire, on réalise ce que l’on appelle une anastomose bilio-digestive qui consiste à venir suturer le petit intestin sur la voie biliaire en faisant une « anse en Y » pour reconstituer une continuité digestive.
Au terme de l’intervention, on met souvent en place un drain en silicone au contact de la zone de la section qui sortira par une toute petite incision abdominale sous la cicatrice. Ce drain, qui a pour objectif d’évacuer vers l’extérieur un écoulement de bile et/ou de sang, est laissé peu de temps si les suites opératoires se passent bien. La paroi abdominale est ensuite refermée en plusieurs plans et des fils et/ou des agrafes sont laissées sur la peau.
Traitement par laparotomie :
Traitement par coelioscopie ou par laparoscopie :
Quels sont les risques de l’intervention ?
La mortalité à 3 mois de la chirurgie hépatique est de 5%. Derrière ce chiffre qui est une moyenne sur un très grand nombre de malades se cachent des différences importantes en fonction de facteurs de risques connus. Les principaux facteurs de risques de mortalité de la chirurgie hépatique sont l’âge, le diabète, la présence d’une cirrhose, l’importance de l’hépatectomie (hépatectomie majeure vs mineure) et la nécessité de réaliser ou non des gestes associés à la chirurgie hépatique. Ainsi la mortalité est inférieure à 1% dans le cas d’hépatectomie mineure sur un foie sain chez un patient de moins de 80 ans mais peut s’élever à plus de 10% s’il s’agit d’une hépatectomie majeure sur foie malade chez un patient âgé.
La principale cause de mortalité après chirurgie hépatique est l’insuffisance hépatique. L’insuffisance hépatique est exceptionnelle après hépatectomie mineure en particulier sur foie sain. L’insuffisance hépatique est une situation très grave où le foie restant n’est pas capable d’assurer les fonctions d’excrétion et de synthèse nécessaires à la vie. En conséquence, il apparait une jaunisse, des troubles de la conscience, un risque de saignement et souvent de l’ascite.
Il n’existe pas de traitement de l’insuffisance hépatique en dehors de la surveillance en milieu hospitalier afin de compenser autant que faire se peut les conséquences de cette situation en attendant que le foie restant réussisse à régénérer. La transplantation hépatique est l’ultime solution dans cette situation si les choses ne s’arrangent pas mais elle n’est que très rarement réalisée et ne peut être envisagée que si la maladie tumorale initiale était limitée au niveau du foie.
Les autres complications les plus fréquentes de la chirurgie hépatique sont l’hémorragie post-opératoire (5%), la fistule biliaire (8-10%) et l’ascite (15%).
L’ascite est la conséquence d’une hyperpression dans le système sanguin digestif. C’est la conséquence d’un foie qui est devenu trop petit ou trop malade pour pouvoir absorber le volume de sang qui arrive dans la veine porte.
La congestion du tube digestif et de la rate entraine une sorte de « sudation » de l’ensemble des organes abdominaux provoquant la formation de plusieurs litres de liquide clair qui s’accumulent dans la cavité abdominale. Ce liquide occasionne une distension de l’abdomen et en l’absence de ponction et/ou de drainage, cette ascite peut s’écouler à travers la cicatrice. En dehors des ponctions, le traitement de l’ascite est médical : des diurétiques et un régime sans sel favorisent l’évacuation de l’ascite par les reins afin de la faire disparaitre entre 2 et 3 mois après la chirurgie.
La fistule biliaire est la conséquence d’une plaie sur l’arbre biliaire qui laisse s’écouler de la bile en dehors des voies naturelles. Si la bile s’écoule vers l’extérieur à travers un drain mis en place au terme de la chirurgie du foie, la fistule biliaire n’aura pas de conséquence clinique. Si la bile ne s’écoule pas à l’extérieur du patient, elle irrite l’intérieur de la cavité abdominale.
Elle est responsable de douleur importante si elle se répand dans l’ensemble du ventre (cholépéritoine) ou de fièvre si la bile s’accumule localement (bilome). La présence d’un cholépéritoine impose une nouvelle intervention alors qu’un bilome se traite par simple drainage. Dans l’immense majorité des cas, les fistules biliaires se tarissent spontanément et la résolution est d’autant plus rapide que la plaie biliaire concerne un petit canicule biliaire qui communique avec le reste de l’arbre biliaire. Si la plaie biliaire concerne un gros tronc biliaire, la fistule biliaire est plus importante et plus lente à guérir, elle peut imposer la mise en place d’une prothèse par voie endoscopique (en passant par le duodénum et le cholédoque) pour fermer le trou de l’intérieur dans certaines situations.
L’hémorragie post-opératoire est la conséquence d’un petit trou dans un vaisseau sanguin qui est passé inaperçu lors de l’opération. S’il a été mis un drain au terme de la chirurgie le sang s’extériorise par le drain, sinon il entraine un hématome révélé par une échographie ou un scanner qui aura été réalisé suite à une chute de la concentration en hémoglobine constatée à la prise de sang. Dans l’immense majorité des cas, la coagulation se fait spontanément et il n’est pas indispensable de ré-intervenir même s’il est parfois nécessaire de réaliser une transfusion sanguine. Si l’hémorragie est mal supportée ou s’il existe des arguments en faveur d’un lâchage d’une suture vasculaire importante, il peut être nécessaire de ré-intervenir ou d’effectuer un traitement radiologique par embolisation artérielle.
Quelles sont les précautions à prendre après l’intervention et lors du retour au domicile ?
Le soir de l’intervention, si la chirurgie a été un peu longue, il est possible que le malade soit surveillé en réanimation. Dans cette situation, la sonde gastrique et la sonde urinaire sont souvent laissées en place 24 heures. La douleur est prise en charge de manière optimale avec, si besoin, des injections de morphine. Il faut rester calme et serein pendant ces premières 24 heures sans trop se mobiliser afin d’éviter d’arracher les drains et/ou les perfusions.
Si les choses se passent normalement, la sonde urinaire et la sonde gastrique sont retirées avant la 48ème heure et le drain abdominal dans la première semaine. une réalimentation est possible dès le lendemain de l’intervention s’il n’a pas été fait de geste sur le tube digestif. même si elle est précoce, la réalimentation doit être légère et fractionnée en petites quantités afin d’éviter les vomissements. Le premier lever ne doit jamais être fait seul en évitant tout effort musculaire important afin de ne pas arracher les fils de la cicatrice. Après l’arrêt de la morphine, des antalgiques doivent être pris de manière systématique afin de prévenir l’apparition des douleurs plutôt que de les traiter. Pendant toute la période d’alitement, il est nécessaire de porter des « bas à varices » et de recevoir des injections quotidiennes d’anti-coagulant afin de diminuer le risque de phlébite. La cicatrice sera laissée à l’air libre à partir du 3ème jour post-opératoire. Les agrafes puis les fils seront retirés entre 7 et 15 jours après l’opération. Afin de favoriser la cicatrisation, il ne faut pas mouiller la cicatrice pendant la première semaine et éviter de prendre des bains avant 1 mois.
Une fois à domicile, une infirmière est souvent nécessaire pour l’injection des anticoagulants et/ou des soins de cicatrices à finaliser. Un contrôle du taux de plaquettes est à réaliser de manière hebdomadaire si un traitement par anti-coagulant est poursuivi à domicile. Il arrive que le malade sorte de l’hôpital avec un drain abdominal. Dans ce cas, il faut noter quotidiennement le débit et l’aspect du liquide qui s’écoule et prévenir le chirurgien si le débit augmente et/ou l’aspect se modifie. A domicile, l’alimentation et les activités doivent devenir de plus en plus normales et si ce n’est pas le cas à cause de douleurs, de fièvre, de frissons ou de tout autre symptôme, il est nécessaire de recontacter son centre référent.
Une consultation post-opératoire est systématiquement réalisée entre 15 jours et 1 mois après l’opération. Cette consultation implique la réalisation d’une prise de sang et d’un examen radiologique dans les jours précédents. C’est à cette consultation que le chirurgien contrôle la qualité de son travail et regarde les résultats de l’examen histologique de la pièce opératoire afin de décider après discussion en réunion de concertation pluridisciplinaire de la nécessité ou non de réaliser une
chimiothérapie complémentaire. C’est à cette consultation que le chirurgien indique s’il est possible de reprendre une activité professionnelle et physique.
Quelles sont les conséquences à moyen et long terme de l’intervention ?
En l’absence de complication, la qualité de vie doit être identique ou supérieure à celle qu’elle était avant l’opération dans les 3 mois qui suivent l’opération. Dans l’immense majorité des cas, il n’y a aucune conséquence clinique à la chirurgie hépatique à distance et en particulier aucun problème d’alimentation.
Les principales conséquences d’une chirurgie hépatique, surtout si elle a été réalisée pour cancer, sont liées à la surveillance à long terme qu’impose ce type de maladies. Il est donc nécessaire de réaliser des examens d’imagerie et des prises de sang tous les 3 mois pendant 2 ans puis tous les 6 mois ensuite afin de traquer une petite récidive qui pourra ainsi bénéficier d’un nouveau traitement efficace.
2. Les autres traitements locaux / régionaux
Qu’est-ce que la radiologie interventionnelle ?
La radiologie interventionnelle est un traitement physique, ce n’est pas un traitement médicamenteux. Le traitement se rapproche donc de la chirurgie mais il ne nécessite pas d’abord opératoire, même minime. Les techniques de radiologie interventionnelle complètent la gamme thérapeutique et autorisent ainsi le traitement de tumeurs qui n’auraient pas pu être traitées, ou de façon moins complète notamment dans le cas où la chirurgie n’est pas possible ou semble très difficile.
Pour détruire la tumeur, le radiologue interventionnel l’atteint, soit en passant dans les artères, soit directement à travers la peau à l’aide
d’une aiguille. Le traitement est donc peu invasif, il s’accompagne de moins de complications qu’une chirurgie classique et nécessite une hospitalisation plus courte.
Concernant le traitement du carcinome hépatocellulaire, deux grandes familles de techniques de radiologie interventionnelle peuvent être considérées :
- La destruction directe de la tumeur en plaçant à travers la peau,
sous le contrôle de l’imagerie, des électrodes (aiguilles) dans la
tumeur et en y faisant passer un courant électrique qui permet
d’augmenter la température (> 100°) à l’intérieur de la tumeur pour la détruire. Il s’agit des techniques de thermo-ablation percutanée dont les plus connues sont la radiofréquence et
les micro-ondes. - la seconde technique est la destruction indirecte de la tumeur
en plaçant un petit cathéter (tuyau) de moins d’un millimètre de
diamètre dans les différentes artères qui vascularisent la tumeur
et en injectant dans ces artères soit de la chimiothérapie, soit de
la radiothérapie, soit des particules pour obstruer les artères et
priver la tumeur de son apport en vasculaire (alimentation). Ce
sont les techniques endovasculaires.
Dans tous les cas ces techniques sont guidées par l’imagerie afin d’être très précises et de ne pas avoir à aborder directement la tumeur (ouvrir l’abdomen). Les techniques utilisées par les radiologues interventionnels peuvent être l’échographie, la radiographie standard, le scanner, exceptionnellement l’IRM.
Dans quels cas ces traitements sont-ils conseillés / nécessaires ?
Le choix de ces traitements dépend :
- de la tumeur elle-même : sa taille, sa localisation dans le foie, sa forme, le fait qu’elle envahisse d’autres structures à l’intérieur du
foie ; - de la fonction du foie qui peut être altérée par la maladie du foie sous-jacente (cirrhose) ;
- de l’état général du patient c’est-à-dire son état de fatigue et son
état de santé global.
L’évaluation par l’imagerie pré-thérapeutique de la position, de la taille et du nombre de lésions à cibler est donc essentielle. La proposition du traitement le plus adapté à chaque situation est classiquement réalisée lors de réunions de concertation pluridisciplinaires auxquelles participent notamment les médecins radiologues.
Les destructions par thermo-ablation percutanée (radiofréquence,
micro-ondes) ne peuvent, sauf cas exceptionnel, être proposées que
pour des tumeurs de relativement petite taille (5 cm au maximum) et en nombre limité (3 lésions). Si la lésion est placée à côté de gros vaisseaux l’efficacité pourra être moindre ; si elle est placée à côté de la bifurcation biliaire, ce type de technique ne pourra pas être proposé car le risque de complications (destruction de ces voies biliaires lors de la destruction de la tumeur) sera trop grand.
Les techniques par voie endovasculaire (chimio-embolisation,
radio-embolisation) s’adresseront plutôt à des tumeurs diffuses à l’ensemble du foie, et plus nombreuses. En revanche, comme elles utilisent le système artériel pour atteindre leur but, elles nécessitent que l’autre système vasculaire du foie (le système porte) soit perméable pour que le foie continue d’être vascularisé pendant le traitement. Enfin, les techniques par voie endovasculaire qui traitent des lésions plus diffuses dans l’ensemble du foie, nécessitent que le foie fonctionne bien (fonction hépatique préservée) pour que l’agression du traitement sur le parenchyme hépatique non tumoral n’entraîne pas une aggravation trop importante de la fonction hépatique.
Combien de temps dure le traitement ?
Pour un traitement par thermo-ablation percutanée, suivant la taille de la tumeur il faut entre 10 et 60 minutes pour obtenir sa destruction (pour certaines techniques de radiofréquence qui utilisent de multiples aiguilles). Avec les techniques plus récentes (micro-ondes), l’ablation est moins longue et peut être obtenue en 4 à 15 minutes. Il s’agit uniquement du temps d’intervention. Il faut également rajouter le temps d’installation, d’anesthésie (ces interventions se déroulent sous anesthésie générale), de préparation, de repérage de la tumeur sous échographie ou sous scanner, et de mise en place des aiguilles au sein ou autour de la tumeur. En tout la procédure dure entre 1h et 2 h 30.
Pour les abords endovasculaires les plus courants tels que la chimio-embolisation, la procédure dépend de l’état des artères. Plus elles sont abimées (athérome par exemple), plus il est difficile et long de gagner les artères qui vascularisent la tumeur du foie. Cela dépend aussi du nombre d’artères qui vascularisent les tumeurs, s’il y en a une ou deux ou s’il y en a une dizaine, puisque toutes seront cathétérisées les unes après les autres. En moyenne l’intervention dure entre 45 minutes et 2h30. A cela, comme pour la destruction percutanée, il faut rajouter le temps d’installation et de préparation. Il n’y a pas d’anesthésie générale pour ces procédures, mais simplement une anesthésie locale.
Certaines procédures par voie endovasculaire telles que la radio
embolisation nécessitent en plus de l’intervention, une intervention
plus légère préalable pour s’assurer de la faisabilité du traitement.
Schéma simplifié du traitement par radiofréquence :
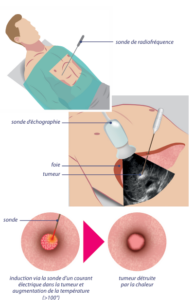
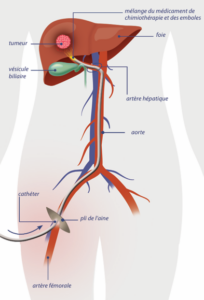
Schéma simplifié du traitement par chimio-embolisation
Comment se passe l’intervention de radiologie ?
Les procédures de radiologie interventionnelle se déroulent dans une ambiance stérile, dans un bloc opératoire spécifique équipé d’appareils d’imagerie qui permettent de suivre les différents éléments (électrodes, aiguilles, cathéters, substance de contraste…) qui seront utilisés et déplacés à l’intérieur du corps pour aller détruire les tumeurs.
Les thermo-ablations percutanées se font sous anesthésie générale.
L’électrode (aiguille) est placée dans la tumeur. Si la tumeur est à côté d’un autre organe sensible (vaisseau, diaphragme) ou de grosse taille, plusieurs aiguilles sont utilisées pour plus de précision et alors positionnées dans ou autour de la tumeur. Les électrodes peuvent être placées sous contrôle de l’échographie ou du scanner. Une fois les électrodes placées, l’induction d’un courant électrique dans ou entre les aiguilles va entraine une augmentation de la température (proche de 100°) à l’intérieur de la tumeur et détruire cette dernière.
Pour les abords endovasculaires, il n’y a pas d’anesthésie générale,
mais seulement une anesthésie locale au point d’entrée dans le système artériel. Il s’agit le plus souvent du pli de l’aine dans l’artère fémorale droite, mais ce peut aussi être un point d’entrée par le bras (l’artère humérale).
Des produits de contraste injectés dans les cathéters vont permettre, à l’aide d’un appareil de radio, d’identifier les artères qui vascularisent (nourrissent) la tumeur. une fois dans les artères qui vascularisent la tumeur, on injectera le produit choisi pour détruire la tumeur (chimiothérapie, produit radio actif). Après injection de la chimiothérapie, il faut obstruer les artères qui nourrissent la tumeur afin de supprimer la vascularisation et favoriser sa destruction.
Comme avant la chirurgie, une consultation avec le radiologue interventionnel, ainsi qu’une consultation avec le médecin anesthésiste sont nécessaires afin de ré-expliquer les objectifs et principaux risques des procédures de radiologie interventionnelle.
Une hospitalisation est-elle nécessaire pour un traitement de radiologie interventionnelle ?
Très exceptionnellement un traitement par radiofréquence simple peut être réalisé le matin et le patient peut ressortir dans la soirée. Dans la très grande majorité des cas, une hospitalisation de 48 à 72h est nécessaire. Elle a pour but de surveiller l’apparition d’éventuelles complications et de prendre en charge correctement la potentielle douleur post intervention.
Pour les traitements endovasculaires, l’hospitalisation est souvent un peu plus longue (3 à 5 jours) car la douleur est souvent un peu plus importante et surtout la fonction hépatique plus abimée par le traitement et donc à surveiller.
Quelle que soit la technique, si une complication survient, la durée d’hospitalisation peut être plus longue (jusqu’à une semaine).
Quels sont les effets secondaires de la radiofréquence ?
L’effet secondaire le plus fréquent est celui d’une douleur pendant les heures qui suivent l’intervention. Celle-ci n’est pas obligatoire mais survient dans un peu plus de la moitié des cas. Dans certains cas, si la lésion traitée a été volumineuse ou si de nombreuses lésions ont été traitées, il existe un effet sur la fonction du foie mais ceci est exceptionnel et spécifique des traitements de tumeur de plus de 5 cm. Une fatigue pendant une ou deux semaines est possible.
La principale complication est le risque d’hématome (saignement à l’intérieur du foie) qui dans le cas extrême peut amener à la réalisation d’un traitement par embolisation. Comme dans les traitements endovasculaires, un cathéter sera alors inséré dans les artères du foie qui saignent afin de les boucher.
Le deuxième risque le plus fréquent est celui d’abcès du foie. La zone traitée peut s’infecter. Si tel est le cas, l’abcès doit être traité par des antibiotiques et vidé par ponction.
Ces deux complications surviennent chez moins d’une personne sur cent.
Quels sont les effets secondaires de la chimio-embolisation ?
La chimio-embolisation a plus d’effets secondaires que la radiofréquence. En effet le traitement est moins ciblé sur la tumeur et s’adresse à des lésions plus diffuses dans le foie. Lors d’une chimio embolisation le parenchyme non tumoral est souvent abimé par le traitement et la fonction du foie altérée transitoirement : le foie retrouvera sa fonction hépatique antérieure au traitement au bout de quelques semaines.
Cette aggravation de la fonction hépatique est la complication la plus grave, notamment dans les quelques cas où elle est majeure et non réversible.
Après le traitement il existe souvent pendant 48h des douleurs et de la fièvre comme lors d’un syndrome grippal.
Les infections sont exceptionnelles, tout comme la perte des cheveux (une perte très partielle) due au passage d’une partie de la chimiothérapie du foie vers l’ensemble de la circulation artérielle
générale.
Quel est le suivi après les traitements par radiologie interventionnelle ?
Le suivi après thermo-ablation percutanée est particulièrement important. un premier contrôle à un ou deux mois permettra de voir si l’intégralité de la tumeur a disparu. Par la suite, un suivi tous les trois mois par scanner ou IRM pendant deux ans, puis tous les six mois sera indispensable. En effet, les tumeurs traitées sont souvent petites, mais il peut en survenir d’autres, et certaines peuvent récidiver. Ce traitement est efficace et peut être répété mais il est limité aux tumeurs de petite taille. Il est donc important de découvrir ces nouvelles tumeurs rapidement pour pouvoir les traiter à nouveau, et donc de suivre rigoureusement le calendrier du suivi en imagerie qui sera proposé par l’équipe de radiologie.
Les traitements par chimio-embolisation sont suivis par scanner ou IRM tous les trois mois, afin d’apprécier l’efficacité du traitement et de suivre la progression de la maladie qui pourrait nécessiter d’autres traitements complémentaires, ou la répétition de la chimio-embolisation.
3. Les thérapies ciblées
Qu’est-ce qu’une thérapie ciblée ?
Une thérapie ciblée est un traitement à base de médicaments dirigés contre une ou plusieurs cibles des cellules cancéreuses et dont l’objectif est de bloquer la multiplication des cellules. Les thérapies ciblées sont des médicaments qui ciblent une protéine surexprimée dans les cellules de la tumeur par rapport aux cellules non tumorales. Idéalement, cette protéine n’est exprimée que dans les cellules tumorales, limitant ainsi les effets secondaires du traitement.
Quelles sont les thérapies ciblées utilisées dans le cancer du foie?
Actuellement, la seule thérapie ciblée qui bénéficie d’une autorisation de mise sur le marché (Amm) dans le traitement des cancers du foie est le sorafénib (Nexavar®). D’autres molécules sont en cours d’évaluation dans le cadre d’essais cliniques.
Le sorafénib ralentit la progression du cancer en bloquant la multiplication des cellules cancéreuses et en empêchant le développement des vaisseaux sanguins qui alimentent la tumeur.
Ce médicament est indiqué :
- lorsque la localisation ou l’extension de la tumeur rend impossible
tout autre traitement ; - lorsque les traitements précédents n’ont pas apporté les résultats
attendus.
Le sorafénib se présente sous la forme de comprimés à avaler. C’est un traitement « systémique », c’est-à-dire qui agit dans l’ensemble du corps. Cela permet d’atteindre les cellules cancéreuses quelle que soit leur localisation dans le corps.
Les doses administrées ainsi que la durée du traitement varient d’une personne à l’autre, en fonction de la réponse du cancer au traitement et de la tolérance.
Avant de débuter ce traitement, un bilan préalable est nécessaire : s’assurer qu’il n’y a pas d’interactions avec le traitement habituel et vérifier que le patient ne présente pas de signes qui pourraient augmenter le risque de complications comme une hypertension artérielle non contrôlée ou des varices œsophagiennes (à rechercher en réalisant une endoscopie digestive) qui devront être traitées le cas échéant.
La posologie habituelle est de deux comprimés deux fois par jour, mais elle peut varier selon la situation personnelle, selon les résultats du bilan biologique ou selon l’intensité des effets secondaires. En cas d’effets secondaires trop importants et invalidants, le traitement peut être interrompu de façon transitoire ou diminué à une posologie inférieure. Ce traitement est maintenu aussi longtemps qu’il est efficace (qu’il contrôle la maladie) et que la tolérance est jugée satisfaisante.
Quels sont les effets secondaires des thérapies ciblées ?
Les effets secondaires les plus courants du sorafenib comprennent :
- une diarrhée : il faut privilégier une alimentation pauvre en fibres,
à base de féculents (pâtes, riz, pommes de terre…). Un traitement
ralentisseur du transit peut être prescrit. - une rougeur, une sensibilité, un gonflement, ou l’apparition de
cloques sur les paumes des mains ou la plante des pieds (appelé
syndrome main-pied) : il faut appliquer régulièrement une crème
hydratante sur la peau, porter des vêtements amples et des chaussures souples et confortables. Il faut éviter l’exposition des
mains et des pieds à la chaleur (eau trop chaude, soleil), les activités exposant à une pression sur les mains ou des mouvements de frottement (vaisselle à la main, jardinage intensif…). - une fatigue ;
- une hypertension artérielle, pouvant justifier l’introduction d’un
traitement anti-hypertenseur ou l’adaptation du traitement
habituel ; - des démangeaisons ou des éruptions cutanées ;
- des nausées et des vomissements ;
- une perte d’appétit ;
- une perte de cheveux, souvent modeste et transitoire.
D’autres effets secondaires moins courants peuvent également apparaitre et devront être discutés avec le médecin.
4. La chimiothérapie et la radiothérapie
Quelle est la place de la chimiothérapie ?
Une chimiothérapie administrée par voie orale ou intraveineuse peut être envisagée. Pour l’instant, le sorafénib (Nexavar®) est le seul traitement apportant une prolongation de l’espérance de vie du patient. Toutefois, certains protocoles de chimiothérapie comme le protocole XELOX (association de capécitabine et d’oxaliplatine) ou le protocole GEmOX (association de gemcitabine et d’oxaliplatine) ont montré qu’ils pouvaient ralentir la croissance de la tumeur chez certains patients. La chimiothérapie systémique ne doit donc pas être administrée à tous les patients mais peut être discutée et proposée au cas par cas si aucune autre option n’est disponible et si l’état général et le bilan biologique le permettent.
Les effets secondaires courants de la chimiothérapie incluent une fatigue, une perte de cheveux, des ulcérations de la bouche, une perte d’appétit, des nausées, des vomissements, des diarrhées et des fourmillements des extrémités augmentés par le froid. Les médicaments peuvent également provoquer des anomalies biologiques notamment une baisse importante des globules blancs (avec un risque accru d’infection), des plaquettes (avec risque d’ecchymoses ou de saignements) et des globules rouges se manifestant par une fatigue intense. Cependant, la plupart de ces effets secondaires peuvent être traités et sont temporaires. Les effets secondaires spécifiques aux molécules utilisées devront être discutés avec le médecin.
Quelle est la place de la radiothérapie ?
La radiothérapie utilise des rayonnements pour tuer les cellules cancéreuses. La radiothérapie peut être proposée dans certaines situations où les autres traitements ne peuvent pas être proposés, sous réserve qu’une quantité suffisante de foie non tumoral puisse être épargnée. Cependant, la place exacte de la radiothérapie dans la prise en charge du cancer du foie n’est pas complètement établie.
Les techniques possibles sont les suivantes :
- La radio-embolisation (radiothérapie interne) par microsphères marquées à l’yttrium 90. La radio-embolisation est une technique innovante qui vise, à l’image de la chimio-embolisation, à délivrer un agent thérapeutique directement dans l’artère nourricière des tumeurs du foie primitives ou secondaires. A la différence de la chimio embolisation, l’agent injecté n’est pas un agent de chimiothérapie, mais de minuscules billes radioactives à l’Yttrium 90 injectées directement dans les artères du foie, concentrant la radioactivité dans les zones tumorales. L’action de ces billes par de la radiothérapie interne va être une destruction locale des tumeurs du foie par irradiation de proximité.
Il s’agit d’une technique de radiologie interventionnelle encore récente
et encore en développement, qui nécessite la pleine collaboration d’équipes multidisciplinaires de radiologie interventionnelle, de médecine nucléaire et d’oncologie hépatique. Le schéma de délivrance se fait généralement en deux séances d’injection, la première visant
à évaluer la faisabilité du geste et l’estimation de la dose, la seconde
consistant à délivrer l’agent thérapeutique. un à deux traitements sont
parfois nécessaires. Cette technique de radio-embolisation fait encore
l’objet d’évaluation dans le cadre d’essais cliniques notamment chez les
patients non réceptifs à la chimio-embolisation hépatique.
- La radiothérapie conformationnelle en trois dimensions consistant à produire des rayonnements par un appareil situé à l’extérieur du corps et à les diriger vers la tumeur. On parle de radiothérapie conformationnelle en trois dimensions, contrairement à la technique classique de radiothérapie externe, car un ordinateur calcule la direction et la forme exacte des faisceaux de rayonnement.
Les effets secondaires de la radiothérapie incluent des rougeurs cutanées dans les zones où les rayons pénètrent dans le corps, des nausées, des vomissements, et le plus souvent, de la fatigue.
- La radiothérapie stéréotaxique. Le Cyberknife ® est un système robotique permettant d’ajuster le faisceau de radiation aux mouvements respiratoires du patient. En effet, le foie bouge avec la respiration du patient et ces mouvements peuvent atteindre plusieurs centimètres. Le Cyberknife ® permet ainsi de traiter des tumeurs très difficiles d’accès avec une grande précision. Il est donc parfois utilisé pour traiter des carcinomes hépatocellulaires non opérables et non éligibles aux traitements standards. Ce traitement nécessite toutefois une planification importante et tous les centres de traitements anticancéreux ne disposent pas d’un appareil Cyberknife®.
5. Soins de supports
Quelle place pour l’alimentation ?
L’alimentation pendant le traitement d’un cancer peut avoir un impact sur le patient et sa maladie. Les traitements anticancéreux peuvent entraîner des nausées, des vomissements, une modification du goût et de l’odorat ou encore une perte complète de l’appétit (anorexie) avec un risque de dénutrition qui conduit à la dégradation de l’état général et peut gêner ou empêcher le traitement. Dans certains cas, la maladie peut à l’inverse entraîner une prise de poids excessive. Les principaux objectifs pendant un traitement sont de stabiliser le poids et le statut nutritionnel.
Des compléments nutritionnels sous des formes variées peuvent
être prescrits.
Il est aussi possible de conseiller un fractionnement des repas (prendre des repas de petits volumes et des collations réparties sur la journée) quand le manque d’appétit empêche une alimentation satisfaisante aux horaires habituels des repas.
Qu’est-ce qu’une ponction d’ascite ?
La ponction d’ascite est une technique utilisée pour prendre en charge l’épanchement d’ascite (présence de liquide jaune/clair dans la cavité abdominale) qui est un symptôme de la maladie du foie sur laquelle s’est développé le cancer.
Elle n’a pas pour objectif de traiter le cancer mais vise à soulager les symptômes (pesanteur, douleurs abdominales, gêne respiratoire) et à assurer une meilleure qualité de vie.
Le liquide en lui-même n’est pas dangereux mais il est susceptible de s’infecter. La ponction d’ascite s’effectue à l’hôpital et consiste à évacuer ce liquide de l’abdomen par le biais d’une fine aiguille passée au travers de la peau, sur le côté gauche du ventre. Un petit volume de liquide peut être prélevé pour être analysé et détecter une éventuelle infection.
Déroulement du geste : l’aiguille est introduite à travers la peau dans la cavité abdominale (sensation proche de celle d’une prise de sang). L’aiguille est ensuite reliée à un tuyau dans lequel s’écoule le liquide qui est recueilli dans un bocal ou une poche au pied du lit. L’évacuation du liquide peut durer une à deux heures durant lesquelles le patient doit rester allongé sur un lit.
La plupart du temps il est possible de rentrer chez soi le soir même. Un régime pauvre en sel et des traitements médicamenteux à base de diurétiques (médicaments favorisant la production d’urine) peuvent également être conseillés selon l’état de santé du patient.
Quelle est la place de l’activité physique adaptée ?
Une activité physique adaptée contribue à améliorer la qualité de vie pendant et après le cancer. Il est également prouvé que l’activité physique, pratiquée dans certaines conditions, réduit le risque de récidive pour certains cancers.
Les professionnels de santé concernés pourront renseigner les patients sur la meilleure façon de la pratiquer. Des associations existent également pour permettre de suivre une activité physique adaptée.
6. La recherche
Quels sont les nouveaux médicaments contre le cancer du foie ?
Il existe peu de médicaments actifs sur le cancer du foie.
Aucune chimiothérapie « classique » intra-veineuse n’a démontré son efficacité lors d’essai thérapeutique.
Dans le carcinome hépatocellulaire, seul le sorafenib (Nexavar®) a montré son efficacité en 2007 lors d’un essai thérapeutique international. Aucun traitement n’ayant été validé auparavant, l’étude comparait le sorafenib à un placebo.
Depuis cette date, de nombreuses thérapies ciblées ont tenté de monter leur efficacité en addition ou en comparaison au sorafenib chez des patients naïfs de toute thérapie ciblée (première ligne), ou chez des malades en échec d’un traitement par sorafenib (seconde ligne). En première ligne, aucun traitement n’a prouvé son efficacité par rapport au sorafenib. En seconde ligne, seul l’essai avec le regorafenib (cousin très proche du sorafenib) vient de montrer son intérêt par rapport au placebo après échec du sorafenib. Cependant, ce traitement n’a pas encore l’autorisation de mise sur le marché (Amm) et ne peut donc pas être utilisé en pratique.
Dans d’autres domaines de l’oncologie (autres organes), l’immunothérapie est actuellement en train de modifier les schémas
thérapeutiques et la survie des malades traités. De nombreuses études sont en cours avec des produits d’immunothérapie, mais aucun résultat n’est actuellement disponible pour le cancer du foie.
Qu’est-ce qu’un essai clinique ?
Un essai clinique est une recherche faite avec la participation des patients. C’est un essai thérapeutique lorsqu’il concerne un traitement.
La recherche clinique est essentielle à l’amélioration des traitements. Elle a permis de faire progresser de façon notable les traitements standards de chimiothérapie. De toute évidence, les patients qui sont inclus dans ces essais thérapeutiques en ont bénéficié avant les autres.
Voici en quelques mots la stratégie suivie pour améliorer les traitements :
- une fois qu’une molécule prometteuse a été identifiée par un laboratoire et que les études précliniques ont été réalisées (expérimentations réalisées avant l’utilisation de la molécule chez l’homme), les essais thérapeutiques de la phase I peuvent commencer. Le but de ces essais est de déterminer les doses tolérées et les effets secondaires et non d’apprécier l’efficacité des
traitements testés ; - la phase II qui suit cherche à vérifier que le traitement est actif.
Cette phase vise à apprécier les réponses tumorales et à analyser
les effets secondaires ; - la phase III est l’étape la plus importante. Quand un traitement actif a été identifié, il faut le comparer aux traitements antérieurs et voir s’il leur est supérieur. Cette étude demande un nombre beaucoup plus grand de patients (parfois plusieurs milliers) et fait l’objet d’une randomisation, c’est-à-dire d’une sorte de tirage au sort élaboré. Ni le patient ni le médecin n’ont le choix du traitement entre l’ancien, correspondant au traitement reconnu actuel, et le nouveau.
Les essais thérapeutiques font l’objet d’une réglementation particulière. Ils sont approuvés par un comité de protection des personnes (CPP), déclarés aux autorités françaises et européennes compétentes et soumis à des règles appelées bonnes pratiques cliniques (bPC). Le patient reçoit une lettre d’information et signe avec son médecin un formulaire de consentement éclairé avant d’entrer dans l’étude. Sa participation est donc totalement volontaire et il peut sortir de l’étude à tout moment s’il le désire.
7. L’évaluation du traitement
Quels examens doivent être pratiqués pendant le traitement ?
Une fois le projet personnalisé de soin (PPS) établi, et le traitement débuté, l’évaluation de l’efficacité et de la tolérance du traitement comporte :
- pour l’évaluation de l’efficacité du traitement : la réalisation d’examens d’imagerie (scanner, IrM) et le contrôle éventuel d’un marqueur sanguin (alpha foetoprotéine AFP) ;
- pour la tolérance : des examens biologiques nécessitant la réalisation d’une prise de sang régulière comportant au minimum une numération sanguine, une évaluation du fonctionnement rénal et une évaluation du fonctionnement du foie.
La fréquence de ces examens dépend du traitement choisi :
- après une résection chirurgicale, une radiofréquence ou une chimio-embolisation les examens sont à réaliser environ 1 mois après le geste puis, si le résultat est jugé satisfaisant, les examens sont répétés tous les 3 mois pendant 2 ans ;
- après la mise en route d’une thérapie ciblée, les examens sont à réaliser environ 2 à 3 mois après le début du traitement, puis tous les 2 à 3 mois pour réévaluer le comportement de la tumeur sous traitement : réponse tumorale (diminution de la taille des lésions), stabilité tumorale (stabilité en nombre et en taille de la/ des tumeur(s)), ou progression tumorale (apparition de nouvelles lésions et/ou augmentation de la taille des lésions connues).
Faut-il une surveillance après le traitement ?
Lorsque les traitements du cancer du foie ont atteint leurs objectifs, le suivi après le cancer commence. Ce suivi est indispensable et s’effectue par la mise en place d’un dispositif adapté à la situation du patient en vue de :
- détecter une éventuelle récidive ;
- détecter des effets indésirables liés au traitement ;
- organiser les soins de support nécessaires et les aides à la vie quotidienne ;
- repérer et prendre en charge les facteurs à l’origine du cancer comme les éventuelles addictions, infections virales et troubles métaboliques ;
- aider à la reprise du travail.
Après le traitement d’un cancer du foie, une surveillance doit être poursuivie tout au long de la vie, pour dépister une récidive du cancer ou l’apparition d’autres complications de la maladie du foie sous-jacente.
Cette surveillance repose sur :
- un examen clinique ;
- le dosage de l’alpha-fœtoprotéine (AFP) (si initialement élevé) au moyen d’une prise de sang ;
- des examens d’imagerie médicale (échographie, voire IrM ou scanner du foie) pour dépister une récidive du cancer ;
- la réalisation régulière de tests biologiques, éventuellement de tests évaluant la dureté du foie, et si besoin, la réalisation d’une endoscopie digestive pour le dépistage des varices oesophagiennes.
Après le suivi trimestriel suivant une résection chirurgicale, une radiofréquence ou une chimio-embolisation, et s’il n’y a pas eu de récidive ayant nécessité un nouveau traitement dans les 2 ans suivant le geste, une surveillance semestrielle (tous les 6 mois) est indispensable. Le respect de cet intervalle permet de diagnostiquer de nouveaux cancers précocement, et de proposer de nouveaux traitements efficaces.
Dans le cas du suivi après une greffe de foie, les consultations s’effectueront dans le centre de transplantation. Ces consultations ont pour objectifs de suivre l’évolution du foie greffé, les complications du traitement immunosuppresseur et l’éventuelle récidive de la maladie initiale au foie. L’organisation et le planning de ces consultations peuvent varier d’un centre à l’autre.
Que signifient rémission, guérison et récidive ?
Rémission : diminution ou disparition des signes d’une maladie. Dans le cas du cancer, on parle de rémission dès lors que toute trace du cancer a disparu. Au bout d’un certain délai, la rémission devient guérison.
Guérison : disparition des symptômes d’une maladie et retour à une bonne santé. Dans le cas du cancer, on parle de guérison dès lors que toute trace de cancer a disparu après un certain temps. Dans le cas du cancer du foie, la guérison du cancer ne doit pas faire oublier la maladie du foie sous-jacente, qui nécessite une surveillance à vie.
Récidive : réapparition de cellules cancéreuses, au même endroit ou dans une autre région du corps. une récidive peut survenir très tôt après la fin des traitements, mais aussi après une longue période de rémission. On parle aussi de rechute.
Auteurs












