Le diagnostic des cancers de l’estomac et du cardia
Quels sont les symptômes des cancers de l’estomac et du cardia ?
À un stade précoce, le cancer de l’estomac ou du cardia ne provoque que peu de symptômes sauf s’il se complique d’un ulcère gastrique ou d’une gastrite atrophique symptomatique.
En dehors d’une perte de poids et d’une fatigue générale, qui sont des symptômes accompagnant les formes déjà relativement évoluées des tumeurs de l’estomac ou du cardia, les symptômes les plus fréquents sont les douleurs gastriques (partie haute et médiane du ventre). Il peut aussi s’agir de brûlures ou de crampes évoquant une faim douloureuse. Vu leur fréquence et leur banalité, ils ne sont pas spécifiques, ce qui rend le diagnostic précoce encore plus difficile. Les douleurs abdominales avec réveil nocturne accompagné parfois de forte accumulation de salive doivent aussi alerter et inciter à consulter. Dans tous les cas, le caractère récent et permanent de ces symptômes doit inciter à consulter et à faire des examens.
Une difficulté à la digestion, avec lenteur de digestion, vomissements ou sensation de blocage lors de l’alimentation lorsque la maladie concerne la partie haute (jonction entre l’œsophage et l’estomac : cardia) ou basse de l’estomac (jonction entre l’estomac et le duodénum : pylore) peut également être l’un des symptômes.
Les saignements digestifs sont potentiellement un autre signe révélateur, plus inquiétant, qui impose de consulter. Il s’agit de sang noir dans les selles lorsque le saignement n’est pas très abondant. Un saignement chronique non visible peut être révélé par une baisse des globules rouges, appelée anémie. La découverte d’une anémie, à l’occasion d’une prise de sang réalisée pour une quelconque raison, peut aussi être révélatrice d’un cancer de l’estomac.
Si les symptômes précédemment décrits sont peu marqués ou ont été ignorés, une des complications suivantes peut révéler le cancer :
- l’hémorragie par voie haute (hématémèse : vomissements de sang rouge) ou par voie basse (rouge lorsque le saignement est très abondant, sinon noir);
- la perforation gastrique, se traduisant par un ventre très dur, très douloureux, avec souvent vomissements et arrêt des selles, suivi par l’apparition rapide d’une fièvre provoquée par l’irritation du péritoine (péritonite);
- une phlébite (obstruction d’une veine par la formation d’un caillot de sang responsable d’une grosse jambe chaude, gonflée et douloureuse) peut aussi révéler un tel cancer (syndrome de Trousseau).
À un stade plus avancé, un ganglion dans le creux au-dessus de la clavicule gauche peut être l’élément révélateur, de même qu’une gêne dans le côté droit de l’abdomen liée à une augmentation de volume du foie, ou encore une augmentation du volume du ventre dans son ensemble (augmentation du périmètre abdominal) en rapport avec la présence d’ascite (liquide anormal dans la cavité péritonéale).
Comment affirmer le diagnostic ?
La confirmation de l’existence d’un cancer de l’estomac ou du cardia ne peut se faire que sur l’examen de biopsies (prélèvement de tissu tumoral). Celles-ci sont obtenues par endoscopie ou oeso-gastroscopie. Cet examen est indispensable au diagnostic d’adénocarcinome* du cardia ou gastrique. Les examens d’imagerie (scanner et IRM) permettent de suspecter le diagnostic mais pas de l’affirmer. L’écho-endoscopie permet également de suspecter un cancer et peut permettre le diagnostic d’une forme infiltrante et particulière de cancer gastrique appelée linite gastrique.
L’endoscopie est l’examen interne qui permet de voir l’intérieur du tube digestif haut en utilisant un tube souple introduit dans l’œsophage par la bouche ou le nez sous anesthésie locale ou générale. Ce tube est constitué de fibres optiques reliées à une caméra miniaturisée qui permet au médecin réalisant l’examen de voir l’intérieur de l’œsophage, de l’estomac et de la partie initiale de l’intestin grêle. Dans ce cas, une anesthésie locale de la gorge est
effectuée. L’examen nécessite une collaboration du patient à qui on demande d’avaler sa salive lorsque le fibroscope est introduit dans l’œsophage afin de faciliter le geste.
L’aspect habituel est celui d’une lésion bourgeonnante, fragile au contact et saignant facilement, ou d’une ulcération (dont l’aspect ressemble à un aphte buccal) avec des bords surélevés. Parfois ce
n’est qu’une simple infiltration de la paroi qui semble épaissie, un peu cartonnée.
On réalise en général plusieurs biopsies (plus de 10) au cours de l’endoscopie pour avoir le plus de chance d’établir le diagnostic d’adénocarcinome gastrique et rechercher des biomarqueurs* d’intérêt pour l’adaptation du traitement médical.
L’endoscopie permet de préciser au chirurgien le site de la lésion au niveau de l’estomac ou du cardia, son aspect, sa taille et son extension tumorale par rapport aux deux orifices gastriques, celui du haut (cardia) et celui du bas (pylore). Il permet en plus des prélèvements de dresser un état des lieux de la tumeur.
Comment savoir si le cancer est localisé ou plus étendu ?
L’étendue du cancer est connue après le bilan d’extension qui recherche des métastases au niveau des ganglions* et des autres organes.
La nature et le stade de la tumeur sont déterminés sur la pièce d’exérèse chirurgicale par l’examen anatomopathologique. Celui-ci consiste à analyser au microscope la tumeur et les ganglions que le chirurgien a enlevés lors de l’opération afin d’y déceler d’éventuelles cellules cancéreuses après fixation de prélèvements et colorations plus ou moins spécifiques (ce qui peut prendre 8 à 15 jours).
Le cancer est dit localisé lorsqu’aucune métastase à distance n’est décelée. Même localisé, après exérèse, le cancer de l’estomac comporte un risque de rechute plus ou moins important selon l’importance de l’infiltration de la paroi de l’estomac ou du cardia et la présence de métastases dans les ganglions proximaux. Ce risque est plus élevé si la tumeur est infiltrante, si elle est révélée par des complications ou si elle a déjà envahi les ganglions proximaux. C’est pourquoi un traitement comportant de la chimiothérapie et parfois de la radiothérapie est indiquée le plus souvent avant l’opération.
Le cancer est dit à un stade avancé lorsqu’il s’accompagne de métastases à distance (foie, péritoine, poumons…) pour lesquelles le traitement principal est une chimiothérapie ± thérapie ciblée.
Quel bilan faut-il pratiquer en cas de cancer de l’estomac ou du cardia ?
Il est nécessaire de pratiquer d’autres examens que l’endoscopie pour le bilan de l’extension du cancer.
L’examen clinique se doit d’être complet avec notamment la recherche d’une diffusion tumorale extragastrique comme un ganglion au-dessus de la clavicule gauche, un gros foie, de l’ascite ou des douleurs osseuses. Le toucher rectal permet de rechercher une infiltration de la partie basse du péritoine et le toucher vaginal chez la femme de rechercher des signes cliniques de métastases ovariennes.
Les examens complémentaires à l’examen clinique nécessaires pour mieux connaître l’extension de la maladie et orienter la conduite thérapeutique sont :
- le scanner thoraco-abdomino-pelvien qui recherche une extension métastatique au niveau du foie, du péritoine, des ganglions ou des poumons. Réalisé avec remplissage d’eau de l’estomac et injection d’un produit de contraste vasculaire en intraveineuse, il permet souvent de visualiser et de mesurer la tumeur gastrique ;
- le dosage des marqueurs tumoraux* (ACE, CA 19.9) peut être demandé lors du bilan initial : lorsqu’il est élevé il pourra servir de référence pour interpréter les dosages ultérieurs effectués au cours du suivi ;
- l’IRM hépatique peut parfois être demandée s’il existe un doute sur une anomalie du foie sur les autres examens ;
- le PET-Scan, examen parfois demandé, également pour apprécier l’extension initiale de la maladie (voir question » Qu’est-ce que le PET-Scan ? ») ;
- une coelioscopie (introduction d’un petit « périscope » dans l’abdomen pour voir la surface de l’estomac et le péritoine qui le recouvre) peut être indiquée lorsqu’existe un doute sur l’existence d’une atteinte péritonéale (carcinose) avant de commencer un traitement médical ou en cas d’intervention comme premier temps opératoire.
La coelioscopie permet d’annuler l’exérèse* prévue au profit d’une chimiothérapie ; en effet celle-ci peut faire régresser cette carcinose et permettre parfois de réaliser secondairement la résection de
l’estomac tumoral.
Le bilan d’opérabilité consiste à apprécier :
- le retentissement nutritionnel, jugé surtout sur l’amaigrissement et/ou le taux de protéine/albumine dans le sang ;
- l’âge physiologique ;
- les fonctions hépatiques et respiratoires.
L’écho-endoscopie est un examen plus spécialisé qui permet d’étudier la paroi en profondeur et de déterminer l’éventuelle présence de ganglions à proximité de l’estomac dont l’aspect peut paraître pathologique. Elle n’est pas toujours nécessaire dans le bilan pré-thérapeutique et est surtout utile dans le cas de tumeurs superficielles ou lorsque l’on hésite sur l’indication d’une chimiothérapie préopératoire. Elle permet aussi de préciser les limites supérieures et inférieures des tumeurs qui conditionnent le choix du type d’intervention à pratiquer.
Quels sont les différents stades de la maladie ?
Les stades du cancer gastrique dépendent de l’extension du cancer.
Différents systèmes de classification existent pour quantifier la gravité de l’atteinte cancéreuse. Ils sont assez proches les uns des autres.
La classification internationale (UICC) est appelée classification TNM et permet de déterminer le stade de l’atteinte cancéreuse : « T » pour tumeur, « N » pour ganglion (node en anglais) et « M »
pour métastase.
Le « T » se réfère à la profondeur de l’atteinte de la paroi de l’estomac par la tumeur ; il est gradué de T1 (tumeur superficielle) à T4 (tumeur très infiltrante qui envahit les organes de voisinage).
Selon la nouvelle classification internationale, le cancer est classé N0 quand les ganglions proximaux ne sont pas envahis, N1 quand un à deux ganglions sont envahis, N2 quand trois à six ganglions sont envahis et N3 quand plus de six ganglions sont envahis par les cellules tumorales (N3a de sept à quinze ganglions envahis, N3b plus de quinze ganglions envahis).
M0 signifie l’absence et M1 la présence de métastases à distance.
Une fois la classification établie, les tumeurs sont regroupées en stades.
Y a-t-il différentes formes de cancers gastriques ?
Oui et les études actuelles ont beaucoup fait progresser nos connaissances.
Depuis longtemps on distinguait deux grandes formes histologiques de cancer gastrique : les formes intestinales (dont la fréquence diminue) et les formes diffuses (dont la fréquence augmente) : c’est la classification dite « de Lauren ».
Actuellement différentes formes de cancers gastriques ont été isolées à partir de leurs caractéristiques moléculaires ce qui a favorisé le développement de classifications moléculaires : avec les outils de biologie moléculaire nous avons pu récemment mieux comprendre les phénomènes de cancérisation. Il est désormais possible d’identifier 4 sous-types moléculaires différents : le sous-type Epstein Barr Virus (EBV) (8,8%) de meilleur pronostic ; le sous-type instabilité microsatellitaire (MSI) (21,7%) qui est un candidat potentiel à l’immunothérapie* ; les tumeurs dites génomiquement stables (19,7%) et les tumeurs génomiquement instables (49,8%).
Quels sont les biomarqueurs à identifier en cas de cancer de l’estomac ou du cardia ?
Un biomarqueur est une altération moléculaire qui a un impact sur la réponse à un traitement ciblé. Ces dernières années, l’analyse des caractéristiques moléculaires des adénocarcinomes de l’estomac ou du cardia a pris de l’importance, en particulier en situation métastatique.
A partir des biopsies réalisées lors de la gastroscopie, on recherche différentes anomalies moléculaires qui peuvent avoir un impact thérapeutique (tableau)
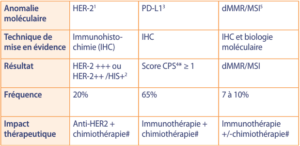
1) Human Epidermal growth-factor Receptor-2
2) Hybridation In Situ
3) Programmed cell Death Ligand-1
4) Combined Positive Score : il correspond à l’expression de PD-L1 sur les cellules tumorales et les cellules immunes du microenvironnement tumoral.
5) Le statut micro- satellitaire tumoral (étude des 4 protéines du système de reconnaissance et de réparation des mésappariements* de l’ADN ou protéines MMR permettant de déterminer s’il existe une perte d’expression de ces protéines, (deficient MMR, ou pas, proficient MMR) est également réalisé dès le diagnostic en situation métastatique ou non métastatique avec confirmation systématique par PCR en biologie moléculaire (polymerase chain reaction) pour confirmer le statut dMMR/MSI (microsatellite instable) ou pMMR/MSS (microsatellite stable).
Parfois une consultation d’oncogénétique est nécessaire selon la protéine concernée par la perte d’expression.
( voir question « Quelle est la place de l’immunothérapie dans le traitement des cancers de l’estomac ou du cardia ? » )
D’autres biomarqueurs d’intérêt comme la recherche de surexpression de la claudine 18 (protéine des jonctions serrées des cellules gastriques) en IHC, sont en développement avec des essais randomisés positifs en faveur d’inhibiteurs dirigés contre la claudine 18 en combinaison avec la chimiothérapie. La surexpression de FGFR2* (récepteur 2 des facteurs de croissance des fibroblastes) se développe également avec des essais thérapeutiques de phase III en cours. Ces biomarqueurs ne sont pas encore recherchés en pratique courante.
Qu’est-ce que le PET-Scan ?
De nouvelles techniques d’imagerie plus performantes sur certains points sont venues compléter les techniques plus classiques qui conservent leurs indications. En effet, l’évaluation de l’extension des cancers gastriques est souvent difficile en particulier en ce qui concerne l’infiltration tumorale du péritoine (membrane recouvrant les viscères) qui n’est pas toujours visible au scanner.
Le PET-Scan, ou tomographie d’émission par positrons, est une technique qui combine un scanner et une scintigraphie pouvant fournir des images de qualité supérieure au scanner seul. Sa réalisation, dans un service de médecine nucléaire, suppose l’injection dans les veines d’un patient à jeun d’une substance appelée 18-fluoro-deoxy-glucose ou 18-FDG. Il s’agit d’un sucre faiblement radioactif : le glucose marqué au fluor 18 va se fixer sur les tissus les plus consommateurs de sucre (ce qui est le cas des cellules tumorales). La scintigraphie détecte alors, lorsqu’ils existent, les foyers tumoraux sous l’aspect de fixation du sucre radioactif ; le scanner couplé à la scintigraphie permet de mieux localiser les anomalies. Cet examen dure en moyenne 2 heures.
Les PET-Scans sont installés dans différentes structures privées ou publiques en France.
Cependant, à ce jour, la démonstration de la supériorité du PET Scan sur des examens plus classiques comme le scanner n’a pas été établie pour les cancers de l’estomac.
Auteurs










